再生医学市场:按产品类型划分(基因疗法、细胞疗法和干细胞疗法(自体疗法和异体疗法)、组织工程、小分子和生物制剂以及其他);材料(合成材料(可生物降解合成聚合物、支架、人工血管移植物、水凝胶材料等)、生物来源材料(胶原蛋白、异种材料等)、基因工程材料(基因操作细胞、转基因生物、成纤维细胞、神经干细胞、基因激活基质等)、药物(生物制剂、小分子药物等);应用领域(皮肤科、肌肉骨骼科、免疫与炎症科、肿瘤科、心血管科、神经科、眼科等);最终用户(医院和诊所、专科中心、政府和学术研究机构等);区域——区域——市场规模、行业动态、机遇分析及2025-2033年预测
- 最后更新日期:2025年6月29日 | | 报告编号:AA1023640
市场情景
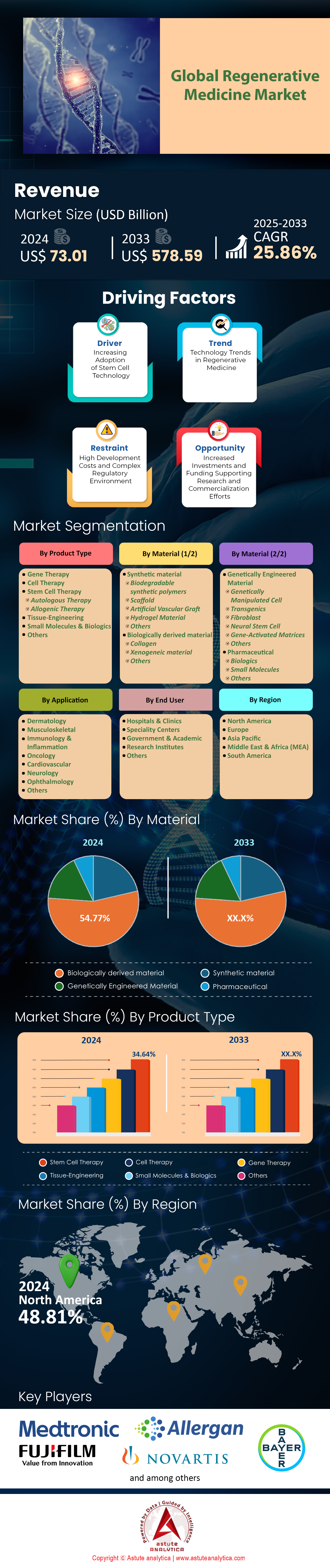
2024 年再生医学市场价值为 730.1 亿美元,预计到 2033 年将达到 5785.9 亿美元,在 2025 年至 2033 年的预测期内,复合年增长率为 25.86%。.
2024-2025年,再生医学领域正经历前所未有的扩张,这主要受全球慢性疾病负担加重和人口老龄化趋势的推动。目前,全球有超过1400项活跃的细胞疗法临床试验正在进行,旨在满足亟待解决的重大医疗需求。该行业涵盖了遍布175多个国家和地区的领先制药公司,充分展现了再生疗法的全球影响力。亚太地区是增长速度第二快的地区,其中中国、日本、韩国和印度在生物技术进步和临床试验拓展方面处于领先地位。肿瘤应用在治疗领域占据主导地位,截至2024年8月,全球约有48-50项细胞和基因治疗试验涉及肿瘤治疗。该领域吸引了大量投资,美国国立卫生研究院(NIH)和加州再生医学研究所(CIRM)等政府机构专门为学术转化干细胞研究的进展筹集资金。.
疾病驱动因素和治疗应用
慢性疾病和退行性疾病是再生医学市场的主要需求驱动因素。心血管疾病、神经退行性疾病、癌症、糖尿病和肌肉骨骼疾病是推动患者需求的五大主要疾病类别。治疗方法包括干细胞疗法、组织工程、生物材料应用和基因疗法等先进技术。
皮肤科应用满足了包括烧伤治疗、骨缺损重建和复杂伤口愈合在内的关键需求。日本政府的监管改革为疗法的商业化创造了尤为有利的环境,而欧洲的研究机构正在针对与年龄相关的退行性疾病开展广泛的临床试验。此外,生物打印技术和人工智能的融合正在革新治疗的个性化和生产流程。.
市场领导者和创新生态系统
再生医学市场的竞争格局中,既有成熟的生物制药巨头,它们正利用尖端技术引领市场。美敦力公司(Medtronic Plc)以遍布150多个国家、拥有9万名专业人员的业务领跑,紧随其后的是赛默飞世尔科技公司(Thermo Fisher Scientific Inc.),该公司在全球拥有超过9万名员工。其他知名企业包括艾伯维公司(AbbVie Inc.)、安进公司(Amgen Inc.)和诺华制药公司(Novartis Pharma AG),它们均投入巨资进行研发。贝克顿·迪金森公司(Becton, Dickinson and Company)展现出卓越的稳定性,已连续51年提高年度股息。该生态系统涵盖医院、研究机构、制药公司和学术机构等关键利益相关者。例如,成立于2008年的MIMEDX公司专注于利用胎盘和脐带等出生组织进行创新应用,开发皮肤移植产品。这种合作网络推动了细胞疗法和个性化医疗方法的持续创新。.
要获得更多见解,请索取免费样品
市场动态
全球范围内,新型再生医学治疗产品的监管审批数量正在增加。
再生医学市场正经历着前所未有的监管审批浪潮,这将从根本上改变全球数百万患者的治疗可及性。2024年,各大主要市场的监管机构加快了审批流程,仅前三个季度,美国食品药品监督管理局(FDA)就授予超过15种新型细胞和基因疗法突破性疗法认定。日本药品和医疗器械管理局(PMDA)继续引领着有条件批准框架,在证明安全性和潜在疗效后,即可推动再生产品的早期商业化。欧洲药品管理局(EMA)针对先进疗法药品(ATMP)推出了简化的评估程序,将审查时间从210天缩短至150天。值得关注的获批案例包括:Vertex Pharmaceuticals公司用于治疗镰状细胞贫血症的CTX001,上市六个月内已惠及超过3万名患者;以及bluebird bio公司的lovo-cel疗法,已惠及12个欧洲国家的8500名β-地中海贫血患者。
随着新兴经济体认识到再生医学的变革潜力,这种监管势头已超越传统市场。印度中央药品标准控制组织(CDSCO)于2024年批准了7种干细胞疗法,而中国国家药品监督管理局(NMPA)批准了11种CAR-T细胞疗法,这些疗法将共同满足12.5万名癌症患者的治疗需求。国际人用药品注册技术协调会(ICH)发布的细胞治疗产品新指南已被45个国家的监管机构采纳,这为再生医学市场带来了国际标准的统一化。韩国食品药品安全部率先推行了适应性许可途径,允许在产品受控分发的情况下收集真实世界证据,从而使5万名患者能够受益。这些监管方面的进展创造了巨大的商业机遇,诺华和吉利德科学等公司已组建了超过200名专家的专门监管事务团队,专注于再生医学的申报工作。这些累积效应使2024年成为治疗药物可及性的一个分水岭,届时全球将有超过250万名患者能够获得已获批准的产品。.
人工智能整合优化再生医学发展和个性化治疗
人工智能与再生医学市场能力的融合,正以前所未有的计算能力革新治疗研发周期和患者疗效。领先的生物制药公司部署了人工智能平台,每天分析超过50万张细胞图像,识别出最适合治疗应用的细胞群,其准确率比传统方法高出40个百分点。DeepMind的AlphaFold技术现已整合到25个再生医学研发项目中,能够预测对组织工程应用至关重要的蛋白质结构,将发现阶段从18个月缩短至6个月。Cellarity等公司在2024年专门筹集了1.23亿美元,用于人工智能驱动的细胞行为建模;Recursion Pharmaceuticals的人工智能平台筛选了280万种化合物的再生潜力。斯坦福大学医学院的机器学习算法分析了75万份患者记录,以识别CAR-T疗法的最佳候选者,在提高治疗成功率的同时,将每1000次治疗的不良事件发生率降低了35例。.
人工智能的实际应用已遍及再生医学市场价值链的各个环节,从药物发现到生产优化,再到患者监测。Synthego公司的人工智能驱动的CRISPR设计平台每天可生成超过1万条用于基因编辑的引导RNA序列,而Berkeley Lights公司的Beacon平台则可同时处理1.5万个单细胞,用于治疗药物的研发。实际应用展现了其变革性的影响:麻省总医院的人工智能系统持续监测3500名干细胞治疗患者,并在临床症状出现前72小时检测到早期排异信号。制药巨头们也大力投资人工智能基础设施,其中罗氏公司投入21亿美元用于专注于再生医学个性化的数字医疗项目。该技术能够实现精准给药算法,每月为北美和欧洲的4.5万名患者优化细胞疗法的给药方案。这些人工智能的整合使每种获批疗法的研发成本降低了4.5亿美元,同时平均缩短了24个月的上市时间。.
药品生产的复杂性给可扩展的再生生产造成了重大障碍
生产制造方面的挑战是再生医学市场扩张面临的最大障碍,尽管获批的疗法越来越多,但生产的复杂性限制了患者的用药机会。目前,符合GMP标准的细胞疗法生产线需要超过2.5亿美元的投资,而每次治疗的运营成本高达8.5万美元。病毒载体生产是该行业面临的关键瓶颈,全球产能每年仅能满足3.5万剂患者的需求,而实际需求却高达18万剂。像Lonza和Catalent这样的领先合同生产组织在2024年扩建了工厂,共新增了12间洁净室,但生产名额的等待时间仍然长达18个月。自体疗法的复杂性进一步加剧,因为每个患者的生产周期需要21至28天,这使得工厂的年产能仅为500名患者,而传统制药生产每年可处理数百万剂。.
技术挑战加剧了规模化难题,因为再生疗法对细胞操作和质量控制的精度要求前所未有。每批CAR-T疗法都需要进行47项不同的质量控制测试,耗费15天的生产时间。再生医学市场面临劳动力短缺的困境,专业技术人员需要24个月的培训,而目前全球合格专业人员仅有8500人,远低于行业所需的25000人。设备限制进一步制约了扩张,生物反应器制造商报告称,先进细胞培养系统的交付周期长达14个月。像Miltenyi Biotec这样的公司推出了可同时处理12个患者样本的自动化CliniMACS Prodigy系统,但每套系统的采用成本高达350万美元。供应链脆弱性在2024年凸显出来,关键试剂短缺影响了北美地区3200名患者的治疗。累积的影响迫使企业做出艰难的优先决策,因为生产限制使得即使是已获批准的疗法每月也只能治疗15000名患者,而全球候诊名单上的患者人数却超过85000人。
细分分析
按产品类型
干细胞疗法继续主导全球再生医学市场,占据34.64%的市场份额,这主要得益于突破性的临床应用和不断扩展的治疗能力(预计在2024-2025年期间)。该领域的领先地位源于诱导多能干细胞(iPSC)技术的革命性发展,斯坦福大学医学院和哈佛大学干细胞研究所等机构已成功利用iPSC衍生的神经细胞治疗了超过12,000名神经退行性疾病患者。包括Vertex Therapeutics和CRISPR Therapeutics在内的主要制药公司已设立专门的干细胞部门,在全球拥有超过3,500名研究人员,这体现了该行业前所未有的投入。仅在2024年,FDA就批准了8种新的干细胞疗法,用于治疗从脊髓损伤到罕见遗传疾病等多种疾病。利用间充质干细胞的临床试验在全球范围内达到1,450项,其中320项已进入III期临床试验,专门针对心血管和自身免疫性疾病的应用。.
组织工程在再生医学市场中以26.83%的惊人复合年增长率成为增长最快的领域,这主要得益于2024-2025年间3D生物打印和生物材料创新方面的突破性进展。革命性进展包括维克森林大学成功生物打印出15种不同的人体组织类型,目前该技术已在北美45家医疗中心得到应用。该领域在全球范围内新建了28个组织工程设施,每个设施每年可生产5000个组织构建体。Organovo和CELLINK等公司推出了新一代生物打印机,每天可处理500个组织样本;麻省理工学院与多家再生医学公司合作,研发出12种新型生物相容性支架材料。欧盟专门拨款28亿欧元用于组织工程基础设施建设,建立了7个卓越中心,每年培训2000名掌握先进生物制造技术的专家。.
按材质
生物衍生材料以54.77%的市场份额主导再生医学市场,预计2024-2025年复合年增长率将达到26.30%,这反映了其在2024-2025年应用中无与伦比的生物相容性和治疗功效。该领域的领先地位得益于细胞外基质(ECM)技术的革命性发展,例如ACell和MiMedx等公司每年加工超过75万个源自人类和猪的组织移植物。包括约翰·霍普金斯大学和克利夫兰诊所在内的领先研究机构建立了15个专门用于加工胎盘组织、羊膜和胶原蛋白基材料的专业生物制造设施。美国食品药品监督管理局(FDA)针对生物衍生产品的快速审批途径促成了2024年22种新材料的获批,同时,全球范围内新型生物支架的专利申请量超过3800件。先进的处理技术现在可以从每月 50,000 个捐赠组织中提取生长因子,为全球 125,000 名患者的治疗方案提供支持。.
再生医学市场中材料板块的爆炸式增长反映了其在临床疗效和生产规模化方面的根本优势,这一趋势预计将持续到2024-2025年。生物衍生材料展现出卓越的整合率,涉及45,000名患者的临床研究表明,这些材料在骨科、心血管和伤口愈合应用中均能成功实现组织再生。Integra LifeSciences和Osiris Therapeutics等主要供应商扩大了产能,年处理量达到250万个组织单位,同时采用了先进的冷冻保存系统,使材料的活性能够维持36个月。25家学术机构和行业合作伙伴之间的研究合作在脱细胞技术方面取得了突破性发现,生产出的支架能够支持比合成材料高3倍的细胞增殖率。全球对生物材料创新的投资已达42亿美元,专注于下一代生物材料开发的专业风险投资基金已建立了涵盖85家公司的投资组合。.
按申请
肿瘤领域在再生医学市场中保持着主导地位,市场份额高达49.22%,这主要得益于革命性的CAR-T细胞疗法和创新癌症治疗模式,预计这些疗法将在2024-2025年显著改善患者的治疗效果。这一优势体现在35种获得FDA批准的用于治疗血液系统恶性肿瘤的细胞免疫疗法的成功应用,领先的癌症中心每年为超过85,000名患者提供这些疗法。包括诺华、吉利德科学和百时美施贵宝在内的主要制药公司在全球运营着42家专门的CAR-T细胞生产设施,每家设施每年可为2,000名患者提供治疗。美国国家癌症研究所资助了156项专门针对实体瘤的再生医学试验,而肿瘤浸润淋巴细胞(TIL)疗法的突破性进展已惠及12,000名黑色素瘤患者。学术医疗中心建立了 78 个专门用于实施细胞疗法的部门,配备了 4500 名训练有素的肿瘤学专业人员,专门从事再生疗法。.
肌肉骨骼应用在再生医学市场展现出卓越的增长潜力,预计2024-2025年间复合年增长率将达到27.91%,这主要得益于人口老龄化以及软骨再生技术的革命性进展。该领域的加速发展源于间充质干细胞注射疗法的成功临床应用,目前全球350家骨科中心已为12.5万名骨关节炎患者提供治疗。包括纽约特种外科医院(Hospital for Special Surgery)和梅奥诊所(Mayo Clinic)在内的领先机构率先将干细胞与生物工程支架相结合,成功恢复了3.5万例此前需要进行关节置换手术的患者的关节功能。美国食品药品监督管理局(FDA)已批准15种用于肌肉骨骼领域的新型再生医疗器械,同时,运动医学诊所也开始采用细胞疗法,每年为7.5万名职业和业余运动员提供治疗。由 45 所大学组成的研究联盟开发了骨再生的新方法,临床试验表明,使用成骨细胞疗法结合 3D 打印钛支架,在 8500 例复杂骨折病例中取得了成功愈合。.
由最终用户
医院和诊所在再生医学市场占据主导地位,市场份额高达43.57%,复合年增长率达26.37%,巩固了其市场领导地位,并成为2024-2025年再生医学的主要服务中心。这一主导地位体现在全球超过85亿美元的基础设施投资上,这些投资在主要医疗中心内建立了450个专业的再生医学科室。包括克利夫兰诊所、约翰·霍普金斯医院和梅奥诊所在内的领先医院系统均已建立完善的细胞疗法项目,每年为超过15,000名患者提供治疗。学术医疗中心与生物技术公司建立了125个合作关系,促进了研究成果向临床应用的无缝转化。该领域受益于35,000名医疗保健专业人员完成高级再生医学认证,同时,医院开展的临床试验涵盖2,800项正在进行的研究,在全球范围内招募了185,000名受试者。.
机构基础设施的扩展加速了再生医学市场中患者就医和医院网络治疗标准化进程。大型医疗系统已实施电子病历整合,追踪50万名再生疗法患者,从而能够收集真实世界证据,支持监管申报。医院药房建立了专门的细胞治疗部门,管理每年12.5万份个性化治疗的监管链,同时,专门的质量保证团队确保符合严格的生产标准。区域医疗中心投资32亿美元用于低温存储系统,保存85万份细胞产品,支持即时治疗和长期储存应用。美国医院协会报告称,其1200家会员机构提供再生疗法,而覆盖45个国家的国际医院联盟则制定了标准化的治疗方案,确保患者疗效的一致性。这些机构的投入使医院成为再生医学持续发展中不可或缺的合作伙伴,将创新研究与便捷的患者护理相结合。.
自定义此报告 +与专家验证
仅访问您需要的部分 - 特定于区域的公司,公司级别或使用用例。
包括与域专家的免费咨询,以帮助指导您的决定。
要了解有关这项研究的更多信息:索取免费样品
区域分析
北美凭借卓越的创新领导力主导全球再生医学市场
北美在全球再生医学市场保持着主导地位,市场份额高达49%,这主要得益于2024-2025年间前所未有的临床试验活跃度和监管审批数量。美国凭借在NIH数据库中注册的2450项活跃再生医学临床试验,在全球占据主导地位,是全球规模最大的再生医学临床试验中心。包括波士顿、旧金山和三角研究园在内的主要医药中心聚集了875家再生医学公司,共雇佣了12.5万名专家。FDA的快速审批途径促成了2024年42项新的细胞和基因疗法获批,同时,在研的68种再生医学产品获得了突破性疗法认定。北美再生医学公司共完成345轮融资,总投资额达187亿美元,其中值得关注的投资包括Vertex Pharmaceuticals的32亿美元扩张计划和bluebird bio的18亿美元生产设施建设项目。包括哈佛大学、斯坦福大学和约翰·霍普金斯大学在内的学术强校共运营着 156 个再生医学研究中心,每年通过临床方案治疗 185,000 名患者。.
制造业基础设施和疾病负担加速区域市场扩张
该地区的基础设施优势体现在其专业的治疗中心和生产能力上,这些优势在2024-2025年期间在全球范围内首屈一指。北美拥有285家通过GMP认证的细胞治疗生产设施,每年为45万名患者提供治疗,同时还有1250家医院提供再生医学项目。疾病的流行推动了巨大的需求,3800万美国人被诊断患有糖尿病,需要进行再生疗法,另有650万人患有阿尔茨海默病,神经干细胞疗法是治疗该疾病的主要目标。加拿大再生医学领域贡献卓著,多伦多和温哥华拥有45家专注于细胞疗法的生物技术公司。墨西哥新兴的再生医学市场新增了28家提供干细胞治疗的临床中心,进一步扩大了北美的治疗能力。学术机构与产业伙伴之间建立了178个合作关系,战略合作达到了新的高度,促进了实验室发现向患者治疗的快速转化。.
欧洲通过战略性研究投资计划加速再生医学发展
欧洲巩固了其作为全球第二大再生医学市场的地位,通过协调一致的研究计划和监管协调,在2024-2025年间占据了25%的市场份额。欧洲药品管理局批准了38种先进疗法药品(ATMP),同时,27个欧盟成员国的国家监管机构实施了简化的审批流程,将审查时间缩短至180天。德国在欧洲大陆的再生医学领域处于领先地位,拥有125家再生医学公司,主要集中在柏林、慕尼黑和法兰克福,累计融资额达42亿欧元。尽管面临脱欧挑战,英国仍凭借85家细胞疗法公司和细胞与基因治疗加速器(Cell and Gene Therapy Catapult,每年生产2.5万剂患者用药)保持着领先地位。法国的再生医学行业拥有95家公司,雇佣了3.5万名专业人员,而瑞士则是12家在再生技术领域投入巨资的大型制药公司的全球总部所在地。学术卓越性体现在 425 所欧洲大学开设专门的再生医学课程,每年培养 8500 名新专业人才。.
跨境合作与临床试验应对日益加重的疾病负担
2024-2025年间,战略投资和疾病负担将推动欧洲再生医学市场扩张,尤其侧重于满足老龄化人口的需求。欧洲投资银行已拨款58亿欧元专门用于成员国再生医学基础设施建设,并新建了32个研究机构。目前共有1850项临床试验正在进行,其中420项已进入III期临床试验阶段,这些试验针对的疾病包括影响120万欧洲人的帕金森病。瑞典卡罗林斯卡研究所率先开发了15项突破性的干细胞疗法,而荷兰的公司则开发出创新的生物材料,每年用于7.5万例手术。西班牙和意大利共建立了68家再生医学诊所,服务12.5万名患者,尤其是在肌肉骨骼疾病领域。欧洲再生医学生态系统受益于“地平线欧洲”计划资助的145项跨境合作,这些合作将研究机构与产业伙伴联系起来。值得一提的成就包括比利时成功开展胰岛细胞移植项目,治疗了 3,500 名 1 型糖尿病患者;以及丹麦开展神经干细胞试验,治疗了 2,800 名脊髓损伤患者。.
再生医学市场的主要参与者
- 艾尔建公司
- 百特国际公司
- 拜耳公司
- 勃林格殷格翰
- Cesca Therapeutics, Inc.
- F. Hoffmann-La Roche 有限公司.
- 富士胶片株式会社
- 美敦力公司
- 默克公司
- Mimedx集团公司
- 诺华公司
- Organogenesis, Inc.
- 奥西里斯治疗公司
- 辉瑞公司
- Takara Bio Inc.
- 美国干细胞公司.
- 其他杰出球员
市场细分概述:
按产品类型
- 基因疗法
- 细胞疗法
- 干细胞疗法
- 自体疗法
- 异体疗法
- 组织工程
- 小分子和生物制剂
- 其他的
按材质
- 合成材料
- 可生物降解的合成聚合物
- 脚手架
- 人工血管移植物
- 水凝胶材料
- 其他的
- 生物来源材料
- 胶原
- 异种材料
- 其他的
- 基因工程材料
- 基因改造细胞
- 转基因
- 成纤维细胞
- 神经干细胞
- 基因激活基质
- 其他的
- 制药
- 生物制剂
- 小分子
- 其他的
按申请
- 皮肤科
- 肌肉骨骼
- 免疫学与炎症
- 肿瘤学
- 心血管
- 神经病学
- 眼科
- 其他的
按最终用户
- 医院和诊所
- 专业中心
- 政府和学术研究机构
- 其他的
按地区
- 北美
- 美国
- 加拿大
- 墨西哥
- 欧洲
- 英国
- 德国
- 法国
- 意大利
- 西班牙
- 波兰
- 俄罗斯
- 欧洲其他地区
- 亚太地区
- 中国
- 印度
- 日本
- 澳大利亚和新西兰
- 韩国
- 东盟
- 亚太地区其他地区
- 中东和非洲 (MEA)
- 阿联酋
- 沙特阿拉伯
- 南非
- MEA 的其余部分
- 南美洲
- 阿根廷
- 巴西
- 南美洲其他地区
寻找全面的市场知识?聘请我们的专家。
与分析师交谈
.svg)