Mercado global de servicios de apoyo a ensayos clínicos: por tipo de ensayo (ensayo clínico centralizado y ensayo clínico descentralizado); tipo terapéutico (moléculas pequeñas, fármacos biológicos, tipos de terapia médica); fases (estudios preclínicos, fase I, fase II, fase III y fase IV); servicios (gestión de centros, reclutamiento de pacientes, gestión de ensayos clínicos, gestión de datos, otros); aplicación (oncología, trastornos del sistema nervioso central y mentales, enfermedades cardiovasculares, enfermedades infecciosas, trastornos sanguíneos, otros); usuarios finales (empresas farmacéuticas y biotecnológicas, organizaciones de investigación por contrato (CRO), empresas de tipos de terapia médica, otros); regional: tamaño del mercado, dinámica del sector, análisis de oportunidades y pronóstico para 2024-2032
- Última actualización: 26-Feb-2024 | | ID del informe: AA0923622
Escenario del mercado
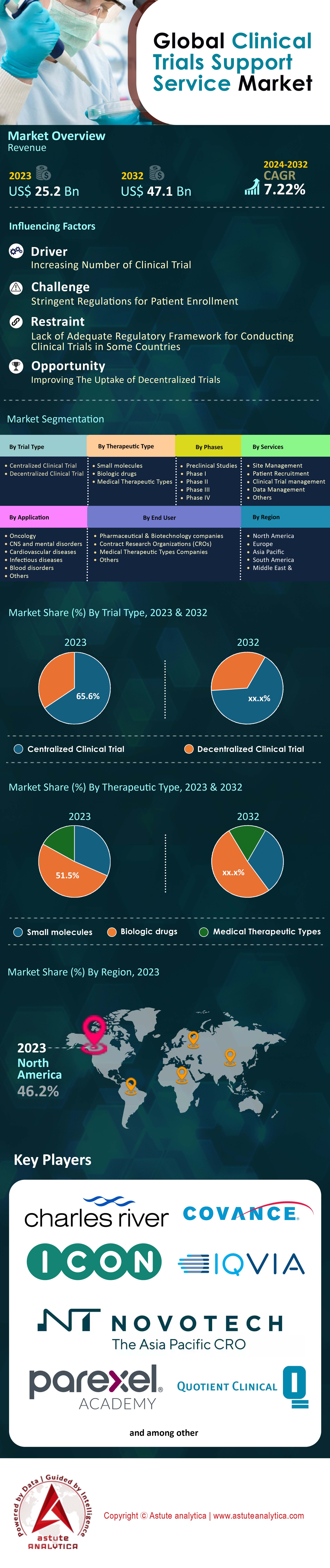
global de servicios de apoyo a ensayos clínicos se valoró en 25,2 mil millones de dólares estadounidenses en 2023 y se proyecta que supere los 47,1 mil millones de dólares estadounidenses para 2032 con una CAGR del 7,22 % durante el período de pronóstico 2024-2032.
El mercado de servicios de apoyo a ensayos clínicos es un pilar fundamental de la industria sanitaria global. Desempeña un papel fundamental en el desarrollo de tratamientos innovadores y terapias revolucionarias. Ante el aumento mundial de diversas enfermedades y afecciones, se pone mayor énfasis en el desarrollo de tratamientos más nuevos, seguros y eficaces. Este impulso ha impulsado significativamente la demanda de servicios de apoyo a ensayos clínicos sólidos y optimizados. Los CDC, en sus publicaciones recientes, destacaron el auge de los ensayos clínicos, especialmente en el ámbito de las enfermedades infecciosas. Este aumento se debe a los recientes desafíos sanitarios globales que han exigido una rápida investigación y desarrollo de soluciones. El enfoque no se centra únicamente en el desarrollo de fármacos, sino también en comprender los efectos a largo plazo y las posibles complicaciones de las enfermedades, lo que impulsa aún más la demanda de un apoyo más amplio a los ensayos clínicos.
La FDA, otro organismo crucial que regula las aprobaciones de medicamentos y los ensayos clínicos en EE. UU., informó un aumento del 15 % en el número de solicitudes de nuevos medicamentos (NDA) presentadas el año pasado. Este aumento, si bien refleja el auge de la industria farmacéutica , también subraya la creciente necesidad de servicios de apoyo a los ensayos clínicos. Con cada nuevo medicamento o solicitud terapéutica, se requiere procesar, gestionar y analizar una gran cantidad de datos, lo que hace indispensable la función de estos servicios de apoyo.
Una tendencia notable en el mercado de servicios de apoyo a ensayos clínicos es la transición hacia ensayos centrados en el paciente. La FDA ha enfatizado la importancia de los resultados informados por los pacientes, lo que añade una capa adicional de complejidad a los ensayos. Los servicios que pueden facilitar el reclutamiento, la retención y la recopilación de datos reales de los pacientes están cobrando importancia. Esta evolución ha provocado un aumento repentino en la demanda de servicios de apoyo especializados, impulsando aún más el mercado. A nivel regional, América del Norte, principalmente Estados Unidos, sigue siendo un actor importante en el mercado de ensayos clínicos. Sin embargo, Asia-Pacífico, liderada por países como China e India, se está consolidando rápidamente como un centro de investigación clínica. Este cambio se debe a la combinación de mano de obra cualificada, infraestructura avanzada y entornos regulatorios favorables. Según los últimos informes, Asia-Pacífico registró una tasa de crecimiento del 9 % en ensayos clínicos, superando la media mundial.
Para obtener más información, solicite una muestra gratuita
Dinámica del mercado
Impulsor: Avances tecnológicos en análisis de datos e inteligencia artificial
La integración del análisis avanzado de datos y la inteligencia artificial (IA) se ha convertido en un factor clave que impulsa el mercado de servicios de apoyo a ensayos clínicos. Históricamente, los ensayos clínicos se han basado en procedimientos manuales, pero el panorama actual ha presenciado avances tecnológicos significativos. Por ejemplo, se estimó que un solo ensayo clínico de fase III generaría más de 3 terabytes de datos en 2022. Con proyecciones que sugieren un aumento anual del 10 % en la generación de dichos datos para 2025, el volumen resulta abrumador.
Para abordar este creciente volumen de datos, las herramientas basadas en IA y analítica avanzada han sido transformadoras. Para 2025, se prevé que más del 65 % de los servicios de apoyo a ensayos clínicos emplearán IA o analítica avanzada similar en sus operaciones. Estos avances no solo son tecnológicos, sino que también tienen implicaciones financieras. El potencial de ahorro de costes derivado de la implementación de herramientas de IA en los procesos de desarrollo de fármacos puede oscilar entre el 15 y el 20 %. Dado que el coste medio de desarrollo de un nuevo fármaco con receta que obtiene la aprobación de comercialización de los servicios de apoyo a ensayos clínicos rondó los 2600 millones de dólares en 2021, el potencial de ahorro de la IA se cifra en miles de millones.
Además, el análisis predictivo basado en IA ha transformado la dinámica de la toma de decisiones en el desarrollo de fármacos. Anteriormente, decidir sobre la viabilidad de una vía de desarrollo farmacológico llevaba meses. Pero con la llegada de la IA, estas decisiones ahora se toman en semanas o, a veces, incluso días. Un estudio demostró que casi el 70 % de las empresas farmacéuticas que utilizan IA lograron reducir a la mitad sus plazos de toma de decisiones.
Tendencia: Mayor énfasis en la diversidad de pacientes en los ensayos clínicos
Una tendencia destacada que cobra fuerza en el mercado de servicios de apoyo a ensayos clínicos es el creciente énfasis en la diversidad de pacientes. Hace unos años, la diversidad en los ensayos clínicos no era un objetivo principal. Sin embargo, en 2019, solo alrededor del 20% de los ensayos clínicos reportaron tener una base de pacientes diversa. Para 2022, esta cifra ascendió al 35%. La trayectoria sugiere que para 2025, podríamos ver más de la mitad de los nuevos ensayos clínicos priorizando la diversidad de pacientes. Los organismos reguladores han influido significativamente en esta tendencia. Por ejemplo, cuando la FDA publicó directrices en 2020 que enfatizaban la necesidad de la diversidad de pacientes en los ensayos clínicos, esto generó un gran impacto en la industria. Tras estas directrices, alrededor del 40% de las compañías farmacéuticas informaron haber revisado sus estrategias de reclutamiento para garantizar una base de participantes más amplia y diversa.
La diversidad en los ensayos clínicos no es solo una cuestión de representación; es una estrategia económicamente viable. Los fármacos que se prueban en una base de pacientes más diversa probablemente enfrentarán menos obstáculos en los procesos de aprobación regulatoria, lo que se traduce en un acceso más rápido al mercado de servicios de apoyo a los ensayos clínicos. Se estima que las empresas que priorizan la diversidad en los ensayos pueden acelerar el tiempo de comercialización de sus fármacos hasta en seis meses. Esto puede aumentar potencialmente sus ingresos entre un 10 y un 15 %. Además, centrarse en la diversidad tiene otro impacto intangible, pero profundo: generar confianza. Las comunidades históricamente subrepresentadas se han mostrado a menudo escépticas respecto a la investigación clínica. Sin embargo, una encuesta de 2022 destacó que el 60 % de los encuestados de estas comunidades estarían más dispuestos a participar en ensayos clínicos si conocieran el compromiso del ensayo con la diversidad.
Desafío: Preocupaciones sobre la privacidad y seguridad de los datos en los ensayos clínicos
En el mercado global de servicios de apoyo a ensayos clínicos, un desafío destaca: garantizar la privacidad y la seguridad de los datos. A medida que los ensayos clínicos se han ido digitalizando, la gran cantidad de datos confidenciales de pacientes generados presenta un mayor riesgo de vulneraciones y acceso no autorizado. La transición a historiales clínicos electrónicos y herramientas de recopilación de datos digitales, si bien ha mejorado la eficiencia, ha amplificado la vulnerabilidad del sistema. En 2021, por ejemplo, se registró un aumento del 30% en los ciberataques dirigidos a datos sanitarios, en comparación con el año anterior. Estos ataques no solo ponen en peligro la integridad del ensayo, sino también la privacidad de los participantes, exponiendo potencialmente su información sanitaria personal.
La naturaleza global de muchos ensayos clínicos también introduce otra capa de complejidad. Cada país tiene sus propios conjuntos de regulaciones y estándares en materia de privacidad de datos. Navegar por estos variados panoramas regulatorios puede ser un desafío para las compañías farmacéuticas y los organizadores de ensayos clínicos. Un estudio de 2022 reveló que casi el 40% de los ensayos clínicos internacionales enfrentaron obstáculos regulatorios debido a discrepancias en los estándares de privacidad de datos entre países. Por lo tanto, las ramificaciones de estos desafíos son múltiples. La confianza, piedra angular de la participación de los pacientes en los ensayos clínicos, está en juego. Si los participantes sienten que sus datos podrían estar en riesgo, es menos probable que se inscriban, lo que puede obstaculizar el progreso de investigaciones que podrían salvar vidas. En una era marcada por la transformación digital, garantizar una sólida privacidad y seguridad de los datos sigue siendo un desafío crítico para el mercado global de servicios de apoyo a los ensayos clínicos.
Análisis segmentario
Por tipo de prueba:
Según el tipo de ensayo, el segmento de ensayos clínicos centralizados destaca en el mercado global de servicios de apoyo a ensayos clínicos. Con una cuota de mercado del 65,6 %, ha consolidado un claro dominio en el sector. Históricamente, los ensayos clínicos centralizados han desempeñado un papel fundamental en el ámbito de la investigación, ofreciendo ventajas en cuanto a protocolos estandarizados, métodos uniformes de recopilación de datos y canales de comunicación optimizados.
También se proyecta que el segmento de ensayos clínicos centralizados crezca a la tasa de crecimiento anual compuesta (TCAC) más rápida, del 7,41 %, durante el período de pronóstico. De confirmarse estas proyecciones, la cuota de mercado del segmento podría acercarse al 70 % para finales de la década, consolidando aún más su liderazgo. Este crecimiento acelerado se atribuye a la creciente complejidad de los ensayos, el aumento de los ensayos clínicos multirregionales y las ventajas que ofrecen los ensayos centralizados en términos de rentabilidad y eficiencia en el tiempo.
Por tipo terapéutico:
En el ámbito terapéutico, el mercado muestra una marcada inclinación hacia los fármacos biológicos. Con una impresionante cuota de mercado del 51,5 %, estos fármacos se han convertido en el pilar del mercado global de servicios de apoyo a ensayos clínicos. Dada su compleja naturaleza y su potencial para tratar una amplia gama de enfermedades, desde trastornos autoinmunes hasta cánceres, los fármacos biológicos han experimentado un aumento en el interés y la inversión en investigación.
Además, la tendencia no parece estancarse pronto. Se espera que los medicamentos biológicos, reflejando el patrón de crecimiento observado en el segmento de ensayos clínicos centralizados, alcancen su tasa de crecimiento anual compuesta (TCAC) más alta, del 7,41 % , en los próximos años. Este crecimiento constante en el segmento de los biológicos se ve impulsado por numerosos factores. La creciente comprensión de la genética, el auge de la medicina personalizada y los continuos avances en biotecnología son solo algunos de los catalizadores que impulsan los biológicos a la vanguardia de la investigación terapéutica.
Por fases:
Por fases de ensayo, la Fase III se perfila como la más dominante en el mercado global de servicios de apoyo a ensayos clínicos, con un importante 48% de la cuota de mercado. Este importante dominio se debe a la importancia crucial de los ensayos de Fase III en el proceso de desarrollo de fármacos. Estos ensayos, a menudo denominados estudios pivotales, involucran a una cohorte mayor de participantes y son fundamentales para evaluar la eficacia y los posibles efectos secundarios del tratamiento en cuestión. Dada la escala y la complejidad de los ensayos de Fase III, requieren amplios recursos, supervisión y gestión, lo que implica una parte considerable de los servicios de apoyo.
Otro factor que refuerza el predominio de la Fase III es su importancia regulatoria. La finalización exitosa de esta fase suele ser la piedra angular para la aprobación regulatoria de organismos como la FDA o la EMA. Dado que los desarrolladores de fármacos buscan asegurar que sus tratamientos en investigación superen esta fase con resultados positivos definitivos, las inversiones en servicios de apoyo para la Fase III son naturalmente elevadas.
Personaliza este informe + Valida con un experto
Acceda solo a las secciones que necesita: específicas de la región, de la empresa o por caso de uso.
Incluye una consulta gratuita con un experto en el dominio para ayudarle a orientar su decisión.
Para saber más sobre esta investigación: Solicite una muestra gratuita
Por Servicios:
Al centrarse en los servicios, el segmento de gestión de ensayos clínicos destaca en el mercado global de servicios de apoyo a ensayos clínicos, con una impresionante cuota de mercado del 54%. La gestión de ensayos clínicos abarca una gama de servicios esenciales, desde el reclutamiento de pacientes, la selección de centros y la gestión de datos hasta el cumplimiento normativo y la elaboración de informes. Dada la compleja naturaleza de los ensayos clínicos modernos, con sus protocolos multifacéticos, la diversidad de poblaciones de pacientes y los estrictos requisitos regulatorios, una gestión eficaz se vuelve imprescindible.
El predominio del segmento de gestión de ensayos clínicos también puede atribuirse a la creciente globalización de estos. Dado que los estudios se realizan en múltiples centros, a menudo en diferentes países o continentes, existe una necesidad imperiosa de una gestión centralizada para garantizar la uniformidad y el cumplimiento de los estándares. Esta demanda de una gestión fluida y coordinada en centros geográficamente dispersos canaliza naturalmente las inversiones y la dependencia hacia los servicios de gestión de ensayos clínicos.
Además, a medida que la industria se inclina hacia enfoques centrados en el paciente y datos reales, los matices de la gestión de ensayos clínicos se han ampliado, lo que subraya aún más la importancia de este segmento de servicios en el mercado global de servicios de apoyo a ensayos clínicos. Garantizar el cumplimiento del paciente, integrar datos reales y aprovechar las herramientas digitales son ahora partes integrales de la gestión de ensayos, lo que requiere servicios de apoyo especializados.
Análisis regional
Norteamérica se erige como líder indiscutible en el mercado de servicios de apoyo a ensayos clínicos, con una impresionante cuota de ingresos del 46,2%. Este dominio de la región se atribuye en gran medida a Estados Unidos, que históricamente ha sido un centro de investigación e innovación médica de vanguardia. Al albergar un número significativo de instituciones de investigación y compañías farmacéuticas de renombre mundial, la región experimenta una importante afluencia de inversiones financieras en investigación clínica. Por ejemplo, solo en 2021, los Institutos Nacionales de la Salud (NIH) destinaron más de 41 000 millones de dólares a la investigación médica. Esta sólida infraestructura de investigación, sumada a los estrictos requisitos regulatorios de la Administración de Alimentos y Medicamentos (FDA), requiere una amplia gama de servicios de apoyo especializados para garantizar el cumplimiento normativo, la eficiencia y la calidad de los ensayos clínicos. Además, el auge de nuevas áreas terapéuticas, como la medicina de precisión y las terapias genéticas, ha incrementado el número de ensayos clínicos en la región en un 8 % interanual, lo que ha impulsado aún más la demanda de servicios de apoyo.
Por otro lado, el mercado europeo de servicios de apoyo a ensayos clínicos se mantiene como un actor importante, con más del 26% de la cuota de mercado en este ámbito. El panorama europeo se enriquece gracias a su diversidad demográfica y de pacientes, lo que ofrece una ventaja única para los ensayos clínicos que buscan resultados más generalizados. En el ejercicio 2021-2022, países como Alemania, Francia y el Reino Unido registraron una inversión combinada de 15 000 millones de euros en investigación clínica, lo que demuestra el compromiso de la región con el avance de la ciencia médica. El atractivo de Europa se ve reforzado por la Agencia Europea de Medicamentos (EMA) y sus constantes esfuerzos por armonizar la normativa entre sus Estados miembros. Estas iniciativas han reducido significativamente las trabas burocráticas que solían asociarse a los ensayos multinacionales en la región. Como resultado, la demanda de servicios de apoyo a ensayos clínicos en Europa ha experimentado un crecimiento anual constante de alrededor del 6%.
Principales actores del mercado global de servicios de apoyo a ensayos clínicos
- Laboratorios Charles River
- Covance Inc.
- Icono PLC
- Servicios farmacéuticos internacionales de inVentiv
- IQVIA
- Corporación de Laboratorio de América Holdings
- Novotech
- Parexel Internacional
- Desarrollo de productos farmacéuticos LLC
- Bioinvestigación de cociente
- Tecnología de aplicaciones WuXi
- Sociedad de Leucemia y Linfoma (LLS)
- Otros jugadores destacados
Descripción general de la segmentación del mercado:
Por tipo de prueba
- Ensayo clínico centralizado
- Ensayo clínico descentralizado
Por tipo terapéutico
- Moléculas pequeñas
- Medicamentos biológicos
- Tipos de terapia médica
Por fases
- Estudios preclínicos
- Fase I
- Fase II
- Fase III
- Fase IV
Por Servicios
- Gestión del sitio
- Reclutamiento de pacientes
- Gestión de ensayos clínicos
- Gestión de datos
- Otros
Por aplicación
- Oncología
- Trastornos del sistema nervioso central y mentales
- enfermedades cardiovasculares
- enfermedades infecciosas
- Trastornos de la sangre
- Otros
Por el usuario final
- Empresas farmacéuticas y biotecnológicas
- Organizaciones de investigación por contrato (CRO)
- Empresas de tipos terapéuticos médicos
- Otros
Por región
- América del norte
- Estados Unidos
- Canadá
- México
- Europa
- El Reino Unido.
- Alemania
- Francia
- España
- Polonia
- Bélgica
- Finlandia
- Países Bajos
- Portugal
- Suecia
- Suiza
- Resto de Europa
- Asia Pacífico
- Porcelana
- India
- Japón
- Australia y Nueva Zelanda
- ASEAN
- Corea del Sur
- Resto de Asia Pacífico
- Oriente Medio y África
- Emiratos Árabes Unidos
- Arabia Saudita
- Katar
- Sudáfrica
- Marruecos
- Resto de MEA
- Sudamerica
- Brasil
- Argentina
- Colombia
- Chile
- Perú
- Resto de Sudamérica
ALCANCE DEL INFORME
| Atributo del informe | Detalles |
|---|---|
| Valor del tamaño del mercado en 2023 | US$ 25.2 mil millones |
| Ingresos esperados en 2032 | US$ 47.1 mil millones |
| Datos históricos | 2019-2022 |
| Año base | 2023 |
| Período de pronóstico | 2024-2032 |
| Unidad | Valor (miles de millones de dólares) |
| Tasa de crecimiento anual compuesta (TCAC) | 7.22% |
| Segmentos cubiertos | Por tipo de ensayo, por tipo terapéutico, por fases, por servicios, por aplicación, por usuario final, por región |
| Empresas clave | Charles River Laboratories, Covance Inc., Icon PLC, inVentiv International Pharma Services, IQVIA, Laboratory Corp. of America Holdings, Novotech, Parexel International, Pharmaceutical Product Development LLC, Quotient Bioresearch, WuXi AppTec, Leukemia & Lymphoma Society (LLS) y otras empresas destacadas |
| Alcance de personalización | Obtenga su informe personalizado según sus preferencias. Solicite personalización. |
¿BUSCA UN CONOCIMIENTO INTEGRAL DEL MERCADO? CONTACTE CON NUESTROS ESPECIALISTAS.
HABLE CON UN ANALISTA
.svg)