Marché mondial des services de soutien aux essais cliniques : par type d’essai (essais cliniques centralisés et décentralisés) ; type thérapeutique (petites molécules, médicaments biologiques, autres types de traitements médicaux) ; phases (études précliniques, phases I, II, III et IV) ; services (gestion des sites, recrutement des patients, gestion des essais cliniques, gestion des données, autres) ; application (oncologie, troubles du SNC et troubles mentaux, maladies cardiovasculaires, maladies infectieuses, maladies du sang, autres) ; utilisateurs finaux (entreprises pharmaceutiques et biotechnologiques, organismes de recherche sous contrat (ORC), entreprises de traitements médicaux, autres) ; analyse régionale : taille du marché, dynamique du secteur, analyse des opportunités et prévisions pour 2024-2032
- Dernière mise à jour : 26 février 2024 | | Numéro de rapport : AA0923622
Scénario de marché
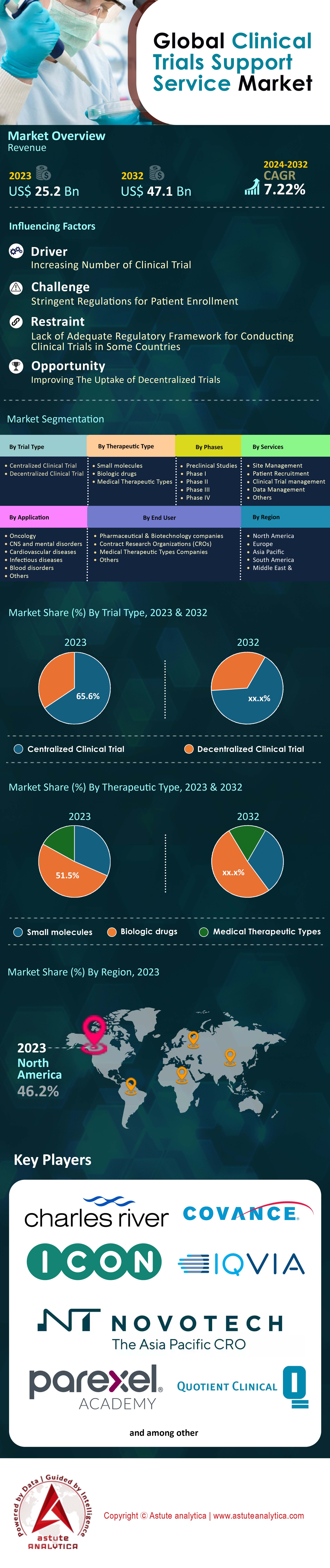
mondial des services de soutien aux essais cliniques était évalué à 25,2 milliards de dollars américains en 2023 et devrait dépasser 47,1 milliards de dollars américains d'ici 2032 , avec un TCAC de 7,22 % au cours de la période de prévision 2024-2032.
Le marché des services de soutien aux essais cliniques est un pilier essentiel de l'industrie mondiale de la santé. Il joue un rôle crucial dans l'avènement de traitements innovants et de thérapies révolutionnaires. Face à la recrudescence de diverses maladies et affections à travers le monde, l'accent est mis de plus en plus sur le développement de traitements nouveaux, plus sûrs et plus efficaces. Cette dynamique a considérablement stimulé la demande de services de soutien aux essais cliniques robustes et optimisés. Dans ses publications récentes, le CDC a souligné cette forte augmentation du nombre d'essais cliniques, notamment dans le domaine des maladies infectieuses. Cette augmentation s'explique par les récents défis sanitaires mondiaux qui ont nécessité une recherche et un développement de solutions rapides. L'attention ne se porte pas uniquement sur le développement de médicaments, mais aussi sur la compréhension des effets à long terme et des complications potentielles des maladies, ce qui alimente encore davantage la demande de services de soutien aux essais cliniques.
La FDA, autre organisme crucial régissant l'approbation des médicaments et les essais cliniques aux États-Unis, a signalé une augmentation de 15 % du nombre de demandes d'autorisation de mise sur le marché (AMM) au cours de l'année écoulée. Cette hausse, tout en témoignant du dynamisme de l' industrie pharmaceutique , souligne également le besoin croissant de services de soutien aux essais cliniques. Chaque nouveau médicament ou application thérapeutique génère une quantité considérable de données à traiter, gérer et analyser, ce qui rend le rôle de ces services de soutien indispensable.
Une tendance marquante du marché des services de soutien aux essais cliniques est l'évolution vers des essais centrés sur le patient. La FDA insiste sur l'importance des résultats rapportés par les patients, ce qui complexifie encore davantage les essais. Les services facilitant le recrutement, la fidélisation et la collecte de données en vie réelle gagnent en importance. Cette évolution a entraîné une forte hausse de la demande de services de soutien spécialisés, stimulant ainsi la croissance du marché. À l'échelle régionale, l'Amérique du Nord, et principalement les États-Unis, demeure un acteur majeur du marché des essais cliniques. Cependant, la région Asie-Pacifique, sous l'impulsion de pays comme la Chine et l'Inde, s'impose rapidement comme un pôle de recherche clinique. Cette évolution s'explique par la combinaison d'une main-d'œuvre qualifiée, d'infrastructures de pointe et d'un environnement réglementaire favorable. Selon les derniers rapports, la région Asie-Pacifique a enregistré un taux de croissance de 9 % pour les essais cliniques, dépassant ainsi la moyenne mondiale.
Pour obtenir plus d'informations, demandez un échantillon gratuit
Dynamique du marché
Facteur déterminant : Progrès technologiques dans l’analyse des données et l’intelligence artificielle
L'intégration de l'analyse de données avancée et de l'intelligence artificielle (IA) est devenue un facteur clé de la croissance du marché des services de soutien aux essais cliniques. Traditionnellement, les essais cliniques reposaient sur des procédures manuelles, mais le contexte actuel est marqué par d'importantes avancées technologiques. On estime qu'un seul essai clinique de phase III générait plus de 3 téraoctets de données en 2022. Avec des projections suggérant une augmentation annuelle de 10 % de la production de ces données d'ici 2025, le volume de données à traiter devient considérable.
Face à cette explosion de données, les outils basés sur l'IA et l'analyse avancée ont été une véritable révolution. D'ici 2025, on prévoit que plus de 65 % des services de soutien aux essais cliniques utiliseront l'IA ou des outils d'analyse avancée similaires. Au-delà des avantages technologiques, les retombées financières sont considérables. Les économies potentielles liées à la mise en œuvre d'outils d'IA dans le développement des médicaments peuvent atteindre 15 à 20 %. Sachant que le coût moyen de développement d'un nouveau médicament sur ordonnance ayant obtenu l'autorisation de mise sur le marché grâce aux services de soutien aux essais cliniques avoisinait les 2,6 milliards de dollars en 2021, le potentiel d'économies de l'IA se chiffre en milliards.
De plus, l'analyse prédictive basée sur l'IA a transformé la dynamique de la prise de décision dans le développement de médicaments. Auparavant, l'évaluation de la faisabilité d'une voie de développement médicamenteux prenait des mois. Désormais, grâce à l'IA, ces décisions sont prises en quelques semaines, voire quelques jours. Une étude a démontré que près de 70 % des entreprises pharmaceutiques utilisant l'IA ont réussi à réduire de moitié leurs délais de décision.
Tendance : Importance accrue accordée à la diversité des patients dans les essais cliniques
L'une des tendances majeures qui prend de l'ampleur sur le marché des services de soutien aux essais cliniques est l'importance croissante accordée à la diversité des patients. Il y a quelques années, la diversité dans les essais cliniques n'était pas une priorité. Cependant, en 2019, seulement 20 % environ des essais cliniques déclaraient inclure une population de patients diversifiée. En 2022, ce chiffre a bondi à 35 %. Cette évolution laisse présager que d'ici 2025, plus de la moitié des nouveaux essais cliniques pourraient privilégier la diversité des patients. Les organismes de réglementation ont fortement influencé cette tendance. Par exemple, lorsque la FDA a publié en 2020 des lignes directrices soulignant la nécessité de la diversité des patients dans les essais cliniques, cela a eu un impact considérable sur le secteur. Suite à ces lignes directrices, environ 40 % des entreprises pharmaceutiques ont déclaré avoir revu leurs stratégies de recrutement afin de garantir une base de participants plus large et plus diversifiée.
La diversité dans les essais cliniques n'est pas seulement une question de représentation ; c'est une stratégie économiquement judicieuse. Les médicaments testés auprès d'une population de patients plus diversifiée sont susceptibles de rencontrer moins d'obstacles lors des procédures d'approbation réglementaire, ce qui se traduit par un accès plus rapide au marché des services de soutien aux essais cliniques. Selon les estimations, les entreprises qui privilégient les essais diversifiés peuvent accélérer la mise sur le marché de leurs médicaments jusqu'à six mois. Cela peut potentiellement augmenter leurs revenus de 10 à 15 %. De plus, l'accent mis sur la diversité a un autre impact, certes intangible, mais néanmoins profond : il renforce la confiance. Les communautés historiquement sous-représentées se sont souvent montrées sceptiques à l'égard de la recherche clinique. Cependant, une enquête menée en 2022 a mis en évidence que 60 % des personnes interrogées issues de ces communautés seraient plus disposées à participer à des essais cliniques si elles étaient informées de l'engagement de l'essai en faveur de la diversité.
Enjeu : Confidentialité et sécurité des données dans les essais cliniques
Sur le marché mondial des services de soutien aux essais cliniques, un défi majeur se distingue : garantir la confidentialité et la sécurité des données. Avec la numérisation croissante des essais cliniques, les volumes considérables de données sensibles générées par les patients sont exposés à un risque accru de violations et d'accès non autorisé. Si la transition vers les dossiers médicaux électroniques et les outils de collecte de données numériques a permis d'améliorer l'efficacité, elle a également accentué la vulnérabilité du système. En 2021, par exemple, on a constaté une augmentation de 30 % des cyberattaques ciblant les données de santé par rapport à l'année précédente. Ces attaques compromettent non seulement l'intégrité de l'essai, mais mettent également en péril la vie privée des participants, risquant d'exposer leurs informations de santé personnelles.
La dimension internationale de nombreux essais cliniques ajoute une complexité supplémentaire. Chaque pays possède ses propres réglementations et normes en matière de protection des données. Naviguer dans ce contexte réglementaire hétérogène peut s'avérer complexe pour les entreprises pharmaceutiques et les organisateurs d'essais cliniques. Une étude de 2022 a révélé que près de 40 % des essais cliniques internationaux se heurtaient à des obstacles réglementaires dus aux disparités des normes de protection des données entre les pays. Les conséquences de ces difficultés sont multiples. La confiance, pierre angulaire de la participation des patients aux essais cliniques, est en jeu. Si les participants craignent pour la sécurité de leurs données, ils seront moins enclins à s'inscrire, ce qui peut freiner des recherches potentiellement vitales. À l'ère de la transformation numérique, garantir une protection et une sécurité robustes des données demeure un enjeu crucial pour le marché mondial des services d'assistance aux essais cliniques.
Analyse segmentaire
Par type de procès :
Selon le type d'essai, le segment des essais cliniques centralisés se distingue nettement sur le marché mondial des services de soutien aux essais cliniques. Représentant une part de marché considérable de 65,6 %, il s'impose comme un acteur incontournable. Historiquement, les essais cliniques centralisés ont toujours joué un rôle essentiel dans la recherche, offrant des avantages tels que des protocoles standardisés, des méthodes de collecte de données uniformes et des canaux de communication optimisés.
Le segment des essais cliniques centralisés devrait également connaître la croissance annuelle composée la plus rapide, à 7,41 %, sur la période prévisionnelle. Si ces projections se confirment, la part de marché de ce segment pourrait potentiellement avoisiner les 70 % d'ici la fin de la décennie, consolidant ainsi sa position de leader. Cette croissance accélérée s'explique par la complexité croissante des essais, la multiplication des essais cliniques multirégionaux et les avantages qu'offrent les essais centralisés en termes de rentabilité et de gain de temps.
Par type thérapeutique :
Sur le plan thérapeutique, le marché affiche une nette préférence pour les médicaments biologiques. Représentant une part de marché impressionnante de 51,5 %, ces médicaments sont devenus incontournables sur le marché mondial des services de soutien aux essais cliniques. De par leur nature complexe et leur potentiel pour traiter un large éventail de maladies, des maladies auto-immunes aux cancers, les médicaments biologiques suscitent un intérêt et des investissements croissants dans la recherche.
De plus, cette tendance ne semble pas près de s'essouffler. Les médicaments biologiques, à l'instar des essais cliniques centralisés, devraient connaître la plus forte croissance annuelle composée ( TCAC) de 7,41 % dans les années à venir. Cette croissance soutenue est alimentée par une multitude de facteurs. L'approfondissement des connaissances en génétique, l'essor de la médecine personnalisée et les progrès constants des biotechnologies ne sont que quelques exemples des catalyseurs qui placent les produits biologiques au cœur de la recherche thérapeutique.
Par phases :
Parmi les différentes phases d'essais cliniques, la phase III domine largement le marché mondial des services de soutien aux essais cliniques, représentant 48 % des parts de marché. Cette position dominante s'explique par le rôle crucial des essais de phase III dans le processus de développement des médicaments. Ces essais, souvent qualifiés d'études pivots, impliquent une cohorte de participants plus importante et sont essentiels pour évaluer l'efficacité et les effets secondaires potentiels du traitement étudié. Compte tenu de leur ampleur et de leur complexité, les essais de phase III nécessitent des ressources, un suivi et une gestion considérables, ce qui représente une part importante des services de soutien.
Un autre facteur qui renforce la prédominance de la phase III est son importance réglementaire. La réussite de cette phase constitue souvent la pierre angulaire de l'obtention de l'autorisation de mise sur le marché auprès d'organismes tels que la FDA ou l'EMA. Les entreprises pharmaceutiques s'efforçant de garantir que leurs traitements expérimentaux franchissent cette phase avec des résultats positifs concluants, les investissements dans les services de soutien à la phase III sont naturellement élevés.
Personnalisez ce rapport + valider avec un expert
Accédez uniquement aux sections dont vous avez besoin - spécifique à la région, au niveau de l'entreprise ou par cas d'utilisation.
Comprend une consultation gratuite avec un expert du domaine pour guider votre décision.
Pour en savoir plus sur cette recherche : demandez un échantillon gratuit
Par services :
En se concentrant sur les services, le segment de la gestion des essais cliniques se distingue sur le marché mondial des services de soutien aux essais cliniques, avec une part de marché impressionnante de 54 %. La gestion des essais cliniques englobe un ensemble de services essentiels, allant du recrutement des patients et de la sélection des sites à la gestion des données, en passant par la conformité réglementaire et le reporting. Compte tenu de la complexité des essais cliniques modernes, avec leurs protocoles multifactoriels, leurs populations de patients diverses et leurs exigences réglementaires strictes, une gestion efficace est indispensable.
La prédominance du secteur de la gestion des essais cliniques s'explique également par la mondialisation croissante de ces essais. Les études étant menées sur de multiples sites, souvent dans différents pays ou continents, une gestion centralisée est indispensable pour garantir l'uniformité et le respect des normes. Cette exigence d'une gestion fluide et coordonnée entre des sites géographiquement dispersés oriente naturellement les investissements et la dépendance vers les services de gestion des essais cliniques.
De plus, à mesure que le secteur s'oriente vers des approches centrées sur le patient et l'utilisation de données en vie réelle, les subtilités de la gestion des essais cliniques se sont accrues, soulignant ainsi l'importance de ce segment de services sur le marché mondial des services de soutien aux essais cliniques. Garantir l'observance du traitement par les patients, intégrer les données en vie réelle et exploiter les outils numériques sont désormais des composantes essentielles de la gestion des essais, nécessitant des services de soutien spécialisés.
Analyse régionale
L'Amérique du Nord domine incontestablement le marché des services de soutien aux essais cliniques, avec une part de marché impressionnante de 46,2 %. Cette position dominante est largement attribuable aux États-Unis, qui ont toujours été un pôle d'excellence en matière de recherche médicale et d'innovation. Abritant un grand nombre d'instituts de recherche et d'entreprises pharmaceutiques de renommée mondiale, la région bénéficie d'un afflux considérable d'investissements financiers dans la recherche clinique. À titre d'exemple, rien qu'en 2021, les Instituts nationaux de la santé (NIH) ont consacré plus de 41 milliards de dollars à la recherche médicale. Cette infrastructure de recherche solide, associée aux exigences réglementaires strictes de la Food and Drug Administration (FDA), nécessite un large éventail de services de soutien spécialisés afin de garantir la conformité, l'efficacité et la qualité des essais cliniques. Par ailleurs, l'essor de nouveaux domaines thérapeutiques, tels que la médecine de précision et les thérapies géniques, a entraîné une augmentation d'environ 8 % du nombre d'essais cliniques dans la région chaque année, alimentant ainsi la demande en services de soutien.
Le marché européen des services de soutien aux essais cliniques, quant à lui, s'impose comme un acteur majeur, détenant plus de 26 % des parts de marché dans ce domaine. La diversité démographique et des populations de patients en Europe constitue un atout considérable, offrant un avantage unique aux essais cliniques visant des résultats plus généralisables. Au cours de l'exercice 2021-2022, des pays comme l'Allemagne, la France et le Royaume-Uni ont investi conjointement 15 milliards d'euros dans la recherche clinique, témoignant de l'engagement de la région en faveur du progrès médical. L'attractivité de l'Europe est renforcée par l'Agence européenne des médicaments (EMA) et ses efforts constants en faveur de l'harmonisation réglementaire entre les États membres. Ces initiatives ont considérablement réduit les obstacles bureaucratiques qui entravaient autrefois les essais multinationaux dans la région. De ce fait, la demande de services de soutien aux essais cliniques en Europe connaît une croissance annuelle soutenue d'environ 6 %.
Principaux acteurs du marché mondial des services de soutien aux essais cliniques
- Laboratoires Charles River
- Covance Inc.
- Icône PLC
- Services pharmaceutiques internationaux inVentiv
- IQVIA
- Sociétés de portefeuille de Laboratory Corp. of America
- Novotech
- Parexel International
- Développement de produits pharmaceutiques LLC
- Quotient Bioresearch
- WuXi AppTec
- Société de leucémie et de lymphome (LLS)
- Autres acteurs marquants
Aperçu de la segmentation du marché :
Par type d'essai
- Essai clinique centralisé
- Essai clinique décentralisé
Par type thérapeutique
- petites molécules
- Médicaments biologiques
- Types thérapeutiques médicaux
Par phases
- Études précliniques
- Phase I
- Phase II
- Phase III
- Phase IV
Par services
- Gestion du site
- Recrutement de patients
- Gestion des essais cliniques
- Gestion des données
- Autres
Par candidature
- Oncologie
- Troubles du SNC et troubles mentaux
- maladies cardiovasculaires
- Maladies infectieuses
- Troubles sanguins
- Autres
Par utilisateur final
- Entreprises pharmaceutiques et biotechnologiques
- Organismes de recherche sous contrat (ORC)
- Entreprises de types thérapeutiques médicaux
- Autres
Par région
- Amérique du Nord
- Les États-Unis
- Canada
- Mexique
- Europe
- Le Royaume-Uni
- Allemagne
- France
- Espagne
- Pologne
- Belgique
- Finlande
- Pays-Bas
- Portugal
- Suède
- Suisse
- Reste de l'Europe
- Asie-Pacifique
- Chine
- Inde
- Japon
- Australie et Nouvelle-Zélande
- ASEAN
- Corée du Sud
- Reste de l'Asie-Pacifique
- Moyen-Orient et Afrique
- Émirats arabes unis
- Arabie Saoudite
- Qatar
- Afrique du Sud
- Maroc
- Reste de la MEA
- Amérique du Sud
- Brésil
- Argentine
- Colombie
- Chili
- Pérou
- Reste de l'Amérique du Sud
PORTÉE DU RAPPORT
| Attribut de rapport | Détails |
|---|---|
| Valeur de la taille du marché en 2023 | 25,2 milliards de dollars américains |
| Revenus attendus en 2032 | 47,1 milliards de dollars américains |
| Données historiques | 2019-2022 |
| Année de référence | 2023 |
| Période de prévision | 2024-2032 |
| Unité | Valeur (Mds USD) |
| TCAC | 7.22% |
| Segments couverts | Par type d'essai, par type thérapeutique, par phases, par services, par application, par utilisateur final, par région |
| Entreprises clés | Charles River Laboratories, Covance Inc., Icon PLC, inVentiv International Pharma Services, IQVIA, Laboratory Corp. of America Holdings, Novotech, Parexel International, Pharmaceutical Product Development LLC, Quotient Bioresearch, WuXi AppTec, Leukemia & Lymphoma Society (LLS), et autres acteurs importants |
| Portée de la personnalisation | Obtenez votre rapport personnalisé selon vos préférences. Demandez une personnalisation |
VOUS CHERCHEZ UNE CONNAISSANCE COMPLÈTE DU MARCHÉ ? ENGAGEZ NOS SPÉCIALISTES EXPERTS.
PARLEZ À UN ANALYSTE
.svg)